Moléculas podem carregar grupos funcionais em sua estrutura que podem ser ionizados ou sofrerem dissociação, em outras palavras, o pH de um sistema no qual um analito está inserido é responsável por manter uma molécula neutra ou propiciar o aparecimento de uma “microespécie iônica”.
O grande terror do cientista moderno reside no fato de que microespécies diferentes apresentam conjuntos de interações intermoleculares e coeficientes de partição diferentes, e consequentemente, perfis diferentes para uma mesma condição cromatográfica (cuja única diferença seja o pH da fase móvel, evidentemente).
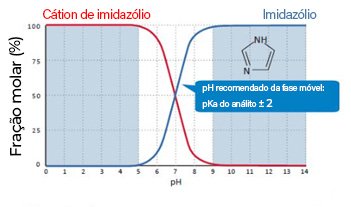
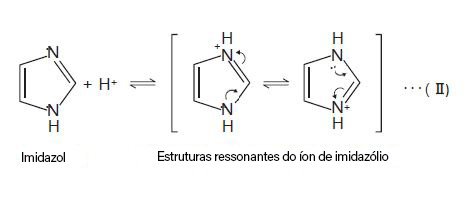
Um exemplo simples a ser apresentado pode ser o imidazol. A molécula tem apenas um coeficiente de dissociação, cujo valor é 7,01. Sendo assim, as faixas de pH de trabalho 100% seguras para se analisar esta molécula seria valores acima de pKa+2 ou valores abaixo de pKa-2. O trabalho em uma região com mais de uma microespécie é particularmente complexo e pode levar aos mais variados tipos de situações caóticas, como por exemplo deformações de sinais analíticos. Vale ressaltar que espécies ionizadas geralmente apresentam um valor de coeficiente de partição baixo (negativo) e que, portanto, são hidrofílicas, sendo assim a sugestão para um método desenvolvido com uma coluna C18 (fase reversa) seria de trabalhar em um pH pelo menos igual a 9.
Uma segunda observação é que o oposto é verdadeiro para ácidos, neste caso valores de pHs menores mantém as carboxilas protonadas enquanto valores maiores levam à um estado dissociado (iônico). Além disso, lembramos que nem sempre um operador tem o “luxo” de trabalhar com uma molécula que possui apenas um valor de pKa, em casos de alta complexidade incentivamos o uso de simuladores para a avaliação de pontos de pH “ótimos”.
A escolha de um pH de trabalho é literalmente apenas metade da solução do problema! Afinal de contas, o operador do instrumento deve ter a certeza de que o valor deste pH será mantido. Este é um trabalho para uma solução tampão!
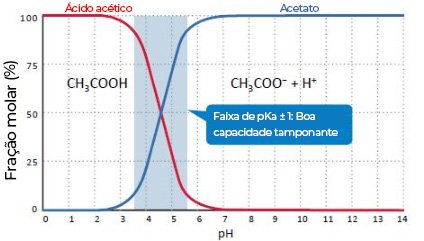
A solução tampão se baseia na utilização de um composto em um certo valor de pH que permita a existência e interconversão entre espécies que se classificariam como por exemplo um ácido e a sua base conjugada, portanto, é extremamente importante que nunca se esqueça que uma solução tampão é dependente da concentração deste componente e de uma faixa de trabalho! Sendo assim, uma solução tampão só tem esse nome em determinadas faixas de pH… fora dela ela é apenas solução. Veja abaixo o exemplo do ácido acético, seu pKa é de 4,56, portanto a sua ação tamponante será considerável apenas na região de [(pKa-1), (pKa+1)].
Encontre abaixo tabelas com os principais tampões utilizados na técnica de HPLC:
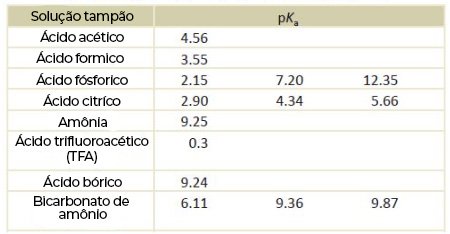
Para mais informações acesse o link